Hauptinhalt
Topinformationen

Prof. Dr. Christian Ungermann
Tel.: +49 541 969-2752
Fax: +49 541 969-2884
Sprechzeiten: Do 12-13
Raum: 67/E34
e-Mail
Biochemie
Forschungsschwerpunkt
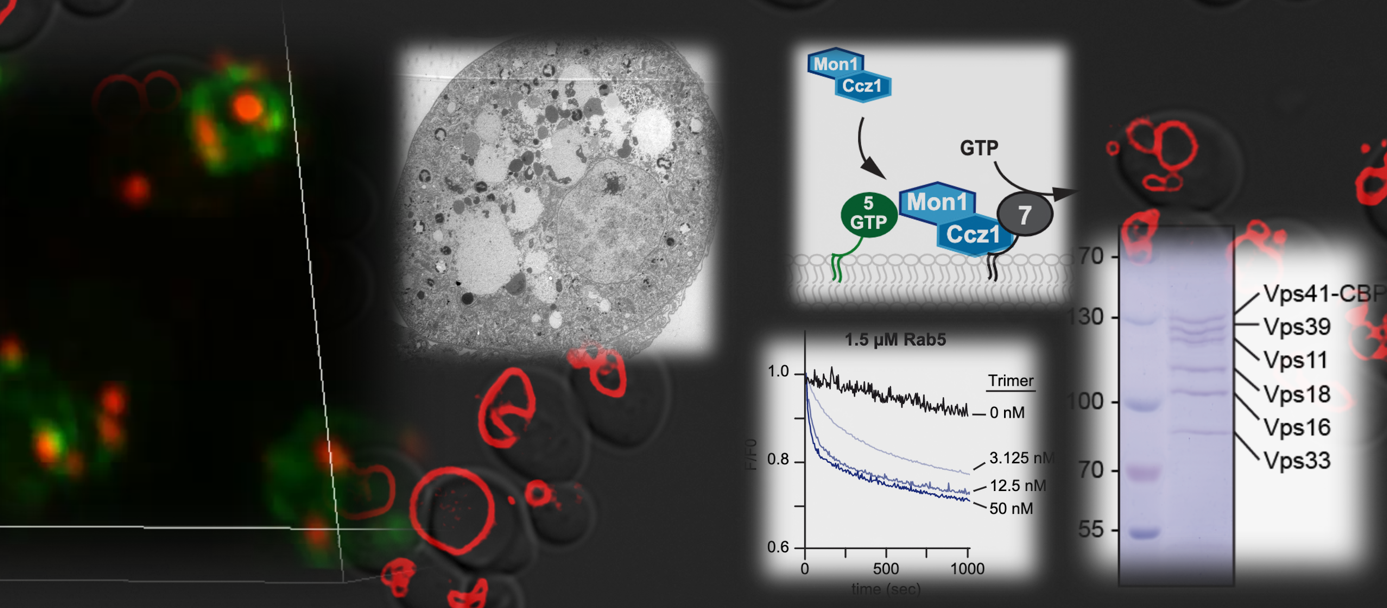
Die Arbeitsgruppe Ungermann untersucht die molekularen Mechanismen der Biogenese von Endosomen, Lysosomen und Autophagosomen. Endosomen stellen eine zentrale Verbindung zwischen der Plasmamembran und dem Lysosom als Verdauungsorganell eukaryotischer Zellen dar. Autophagosomen werden gebildet, um Proteine oder gesamte Organellen abzubauen und deren Bestandteile wiederzuverwerten. Die Ungermann-Gruppe kombiniert zellbiologische Methoden mit in vitro Rekonstitutionen auf Membranoberflächen, um die Funktion der beteiligten Proteine, und damit auch deren Funktion bei der Entstehung von Krankheiten, zu verstehen.
Forschungsthemen
- Molekularer Mechanismus der endosomalen Reifung und Fusion
- Biogenese von Autophagosomen und Lysosomen
- Endosomale Signalübertragung
Modellsysteme
- Saccharomyces cerevisiae (Bäckerhefe)
- Rekonstituierte Membransysteme
- Insektenzellkultur und in Kooperation Drosophila melanogaster
Methoden
- Aufreinigung von Proteinen und großer Proteinkomplexe
- Fluoreszenzmikroskopie
- Enzymatische Aktivitätsassays Rekonstitution von Membranproteinen in Liposomen
- Membranfusionsassays
Ausgewählte Publikationen
- Langemeyer L, Borchers A-C, Herrmann E, Füllbrunn N, Han Y, Perz A, Auffarth K, Kümmel D, & Ungermann C (2020) A conserved and regulated mechanism drives endosomal Rab transition. Elife 9: e56090doi: 10.7554/eLife.56090 pdf
- Chen Z, Malia PC, Hatakeyama R, Nicastro R, Hu Z, Péli-Gulli M-P, Gao J, Nishimura T, Eskes E, Stefan CJ, Winderickx J, Dengjel J, De Virgilio C, & Ungermann C (2021) TORC1 Determines Fab1 Lipid Kinase Function at Signaling Endosomes and Vacuoles. Curr Biol 31: 297-309.e8, doi: 10.1016/j.cub.2020.10.026 pdf
- Gao J, Langemeyer L, Kümmel D, Reggiori F, & Ungermann C (2018) Molecular mechanism to target the endosomal Mon1-Ccz1 GEF complex to the pre-autophagosomal structure. Elife 7: e31145, doi: 10.7554/eLife.31145. pdf