Hauptinhalt
Topinformationen
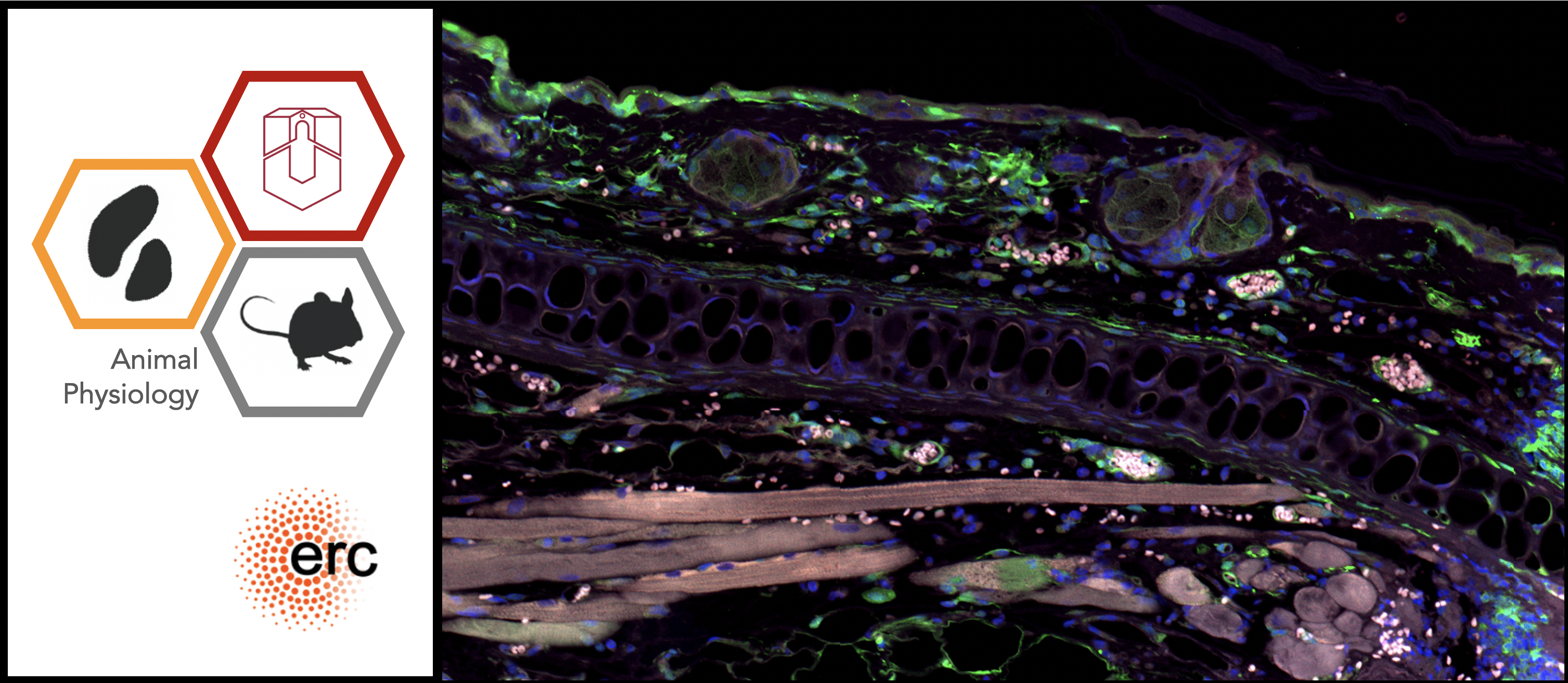
Mechanismen der Organ- und Geweberegeneration
Forschungsschwerpunkt
Unser Team versucht zu verstehen, warum manche Tiere Gewebe, Organe, oder ganze Körperteile regenerieren können und andere nicht. Dazu vergleichen wir hoch regenerative Organismen, wie z.B. Plattwürmer und Stachelmäuse (Acomys) mit ihren nahen Verwandten, die Verwundungen nur durch Narbenbildung heilen können. Wir nutzen außerdem in vitro Methoden, wie induzierte pluripotente Stammzelltechnologie (iPSC) zur Herstellung von Gewebekulturen, um unsere in vivo Regenerationsstudien zu ergänzen und teilweise zu ersetzen. Unser Ziel ist es, Wege zu finden, die Regenerationsfähigkeit des Menschen in Zukunft zu verbessern.
Forschungsthemen
- Narbenfreie Regeneration der Haut
- Reperaturprozesse am Herzen
- Molekulare Stressantwort nach Verwundung
- Evolution der Regeneration
Modellsysteme
- Planarien (Plattwürmer)
- Stachelmäuse (Acomys)
- iPSC-abgeleitete Herzmuskelzellen und andere Zelltypen
Methoden
- Räumlich-auflösende Transkriptomanalysen (Tomo-Seq)
- Einzelzellanalysen (scRNA-seq)
- Mikroskopische Analysen von Molekülen und subzellulären Strukturen
- Induzierte pluripotente Stammzelltechnologie (iPSC)
Ausgewählte Publikationen
- Koopmans T, van Beijnum H, Roovers EF, Tomasso A, Malhotra D, Boeter J, Psathaki OE, Versteeg D, van Rooij E, & Bartscherer K (2021) Ischemic tolerance and cardiac repair in the African spiny mouse. npj Regenerative Medicine 6:78, doi.org/10.1038/s41536-021-00188-2. pdf Pressemitteilung
- Schmidt D, Reuter H, Hüttner K, Ruhe L, Rabert F, Seebeck F, Irimia M, Solana J, & Bartscherer K (2018) The Integrator complex regulates differential snRNA processing and fate of adult stem cells in the highly regenerative planarian Schmidtea mediterranea. PLoS Genet 14, e1007828, doi.org/10.1371/journal.pgen.1007828. pdf
- Owlarn S, Klenner F, Schmidt D, Rabert F, Tomasso A, Reuter H, Mulaw M, Moritz S, Gentile L, Weidinger G, & Bartscherer K (2017) Generic wound signals initiate regeneration in missing-tissue contexts. Nat Commun 8, 2282, doi.org/10.1038/s41467-017-02338-x. pdf