Hauptinhalt
Topinformationen
Neurobiologie

Prof. Dr. rer. nat. Roland Brandt
Tel.: +49 541 969-2338
Fax: +49 541 969-2354
Sprechzeiten: Fr. 11-12 mit Voranmeldung sowie n. V.
Raum: 36/313
e-Mail
Forschungsschwerpunkt
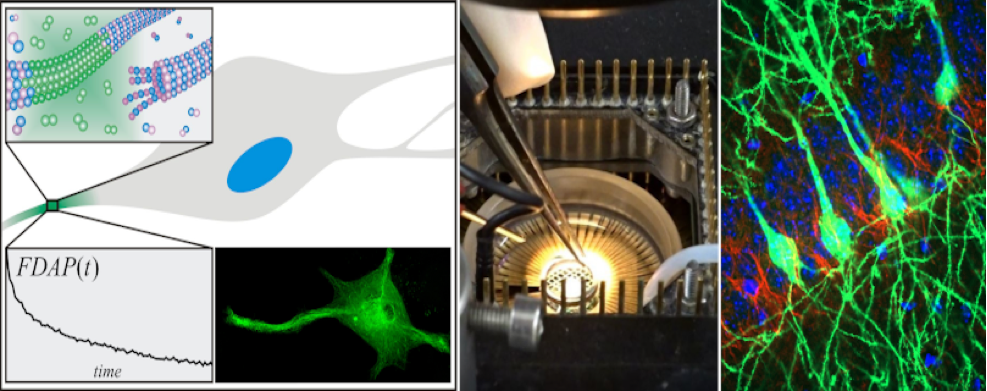
Die Forschung der Abteilung Neurobiologie konzentriert sich auf die Untersuchung der Entwicklung und Degeneration von Nervenzellen auf der molekularen, zellulären und systemischen Ebene. Ein großer Teil der Arbeitsgruppe beschäftigt sich dabei mit den Mechanismen, die dem Krankheitsverlauf bei der Alzheimerschen Erkrankung zugrundeliegen. Eine wesentliche Rolle spielt dabei ein Protein des neuronalen Zellskeletts, das Tau Protein, dessen (Fehl-)funktionen wir unter anderem mit "live cell imaging" Verfahren in Zell- und Gewebemodellen untersuchen.
Forschungsthemen
- Molekulare Mechanismen der Alzheimerschen Erkrankung
- Das Zellskelett bei der Entwicklung und beim Altern von Nervenzellen
- Molekulare Mechanismen von Zellstress
Modellsysteme
- Neuronale Zellkulturen
- Organotypische Hirnschnitte
- Transgene Mausmodelle
Methoden
- Zell- und Gewebekulturen
- Viraler und nicht viraler Gentransfer
- "Live cell imaging" und algorithmenbasierte Bildanalyse
- Extrazelluläre Ableitungen mit einem Multielektrodenarray
Ausgewählte Publikationen
- Hrynchak MV, Rierola M, Golovyashkina N, Penazzi L, Pump WC, David B, Sündermann F, Brandt R, Bakota L (2020) Chronic presence of oligomeric Aβ differentially modulates spine parameters in the hippocampus and cortex of mice with low APP transgene expression. Front Synaptic Neurosci, 12:16, doi: 10.3389/fnsyn.2020.00016. pdf
- Niewidok B*, Igaev M*, Pereira da Graca A, Strassner A, Lenzen C, Richter CP, Piehler J, Kurre R, Brandt R (2018) Single-molecule imaging reveals dynamic biphasic partition of RNA-binding proteins in stress granules. (*joint first authors) J Cell Biol, 217, 1303–1318, doi: 10.1083/jcb.201709007. pdf
- Gauthier-Kemper A*, Suárez Alonso M*, Sündermann F, Niewidok B, Fernandez MP, Bakota L, Heinisch JJ, Brandt R (2018) Annexins A2 and A6 interact with the extreme N-terminus of tau and thereby contribute to tau’s axonal localization (*joint first authors). J Biol Chem, 293, 8065-8076, doi: 10.1074/jbc.RA117.000490. pdf