Main content
Top content
Forschungsprojekte
Redox-Regulation in Chloroplasten: Post-translationale Mechanismen und Feinregulation
Das Ferredoxin-Thioredoxin-System überträgt Elektronen aus der oxygenen Photosynthese auf Schlüsselenzyme des Chloroplastenstoffwechsels. Diese kovalente Redoxmodifikation ist Grundlage für die individuelle Regulierbarkeit der Zielenzyme. Ihre Redoxpotentiale werden durch Stoffwechsel-Intermediate spezifisch verändert, wodurch die Flüsse jeweils dem Bedarf angepasst werden.
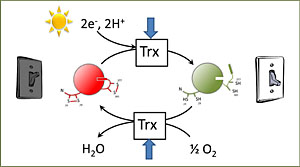
Licht-/Dunkelmodulation: Kovalente Redox-Modifikation von Chloroplastenenzymen dient als "Lichtschalter" mit Dimmerfunktion, um Enzymaktivitäten der Assimilation und der Energiedissipation dem Bedarf anzupassen.
Da die Redoxmodulierbarkeit der Chloroplastenenzyme erst nach der Entstehung der oxygenen Photosynthese etabliert werden konnte, wurden − beginnend mit den Cyanobakterien − redox-modulierte Enzyme aus Organismen verschiedener phylogenetischer Entwicklungsstufen auf das Vorkommen der redox-aktiven Cysteine bzw. der regulatorischen Sequenzbereichen untersucht. Wie für NADP-Malatdehydrogenase, konnte auch für NADP-Glycerinaldehyd-3-P-Dehydrogenase, Phosphoribulokinase, Fruktose-1,6-bisphosphatase und Glukose-6-P-Dehydrogenase gezeigt werden, dass erst im Laufe der Evolution die "perfekt" regulierten Formen entstanden sind. Die reversible Redox-Reaktion an den Zielenzymen ist die Basis für die Feinregulation zur individuellen Anpassung der Stoffwechselflüsse.
Literatur:
- Knüsting, J. and Scheibe, R. (2018) Small molecules govern thiol-redox switches. Trends in Plant Science 23(9): 769-782. doi.org/10.1016/j.tplants.2018.06.007
- Hanke, G. T., and Scheibe, R. (2017) The contribution of electron transfer after photosystem I to balancing photosynthesis. "Photosynthesis and Bioenergetics", ed. Ruban, A. V., World Scientific Publishing Company, Singapore: pp. 277-303
- Kozuleva, M., Goss, T., Twachtmann, M., Rudi, K., Trapka, J., Selinski, J., Ivanov, B., Prashant, G., Steinhoff, H.-J., Hase, T., Scheibe, R., Klare, J., Hanke, G. (2016) Ferredoxin: NADP(H) oxidoreductase abundance and location influences redox poise and stress tolerance. Plant. Physiol. 172(3); 1480-1493
- Henne, M., König, N., Triulzi, T., Baroni, S., Forlani, F., Scheibe, R., and Papenbrock, J. (2015) Sulfurtransferase and thioredoxin specifically interact as demonstrated by bimolecular fluorescence complementation analysis and biochemical tests. FEBS Open Bio 5 (2015) 832-843
- Muthuramalingam, M., Matros, A., Scheibe, R., Mock, H.-P., and Dietz, K.-J. (2013) The hydrogen peroxide-sensitive proteome of the chloroplast in vitro and in vivo. Frontiers in Plant Science 4: Article 54.
- Buchanan, B.B., Holmgren, A., Jacquot, J.-P., and Scheibe, R. (2012) Fifty years in the thioredoxin field and a bountiful harvest. Biochim. Biophys. Acta 1820: 1822-1829.
- Heineke, D. and Scheibe, R. (2009) Photosynthesis: The Calvin cycle. In: Encyclopedia of Life Sciences. John Wiley & Sons, Ltd.: Chichester: http//www.els.net/ (DOI:10.1002/9780470015902.a0001291.pub2).
- Oesterhelt, C., Klocke, S., Holtgrefe, S., Linke, V., Weber, A.P.M. and Scheibe, R. (2007) Redox regulation of chloroplast enzymes in Galdieria sulphuraria in view of eukaryotic evolution. Plant Cell Physiol. 48: 1359-1373.
- Reichert, A., Dennes, A., Vetter, S. and Scheibe, R. (2003) Chloroplast fructose 1,6-bisphosphatase with changed redox modulation: Comparison of the Galdieria enzyme with cysteine mutants from spinach. Biochim. Biophys. Acta 1645: 212-217.
- Scheibe, R., Wedel, N., Vetter, S., Emmerlich, V. and Sauermann, S.-M. (2002) Coexistence of two regulatory NADP-glyceraldehyde 3-P dehydrogenase complexes in higher plant chloroplasts. Eur. J. Biochem. 269: 5617-5624.
- Backhausen, J.E., Kitzmann, C., Horton, P. and Scheibe, R. (2000) Electron acceptors in isolated intact spinach chloroplasts act hierarchically to prevent over-reaction and competition for electrons. Photosynth. Res. 64: 1-13.
- Reichert, A., Baalmann, E., Vetter, S., Backhausen, J.E. and Scheibe, R. (2000) Activation properties of the redox-modulated chloroplast enzymes glyceraldehyde 3-phosphate dehydrogenase and fructose 1,6-bisphosphatase. Physiol. Plant. 110: 330-341.
- Fridlyand, L.E. and Scheibe, R. (2000) Regulation in metabolic systems under homeostatic flux control. Arch. Biochem. Biophys. 374: 198-206.
- Fridlyand, L.E., Backhausen, J.E. and Scheibe, R. (1999) Homeostatic regulation upon changes of enzyme activities in the Calvin cycle as an example for general mechanisms of flux control. What can we expect from transgenic plants? Photosynth. Res. 61: 227-239.
- Backhausen, J.E. and Scheibe, R. (1999) Adaptation of tobacco plants to elevated CO2: Influence of leaf age on changes in physiology, redox state and NADP-malate dehydrogenase activity. J. Exp. Bot. 50: 665-675.
- Wenderoth, I., Scheibe, R. and von Schaewen, A. (1997) Identification of the cysteine residues involved in redox modification of plant plastidic glucose-6-phosphate dehydrogenase. J. Biol. Chem. 272: 26985-26990.
- Holtgrefe, S., Backhausen, J.E., Kitzmann, C. and Scheibe, R. (1997) Regulation of steady-state photosynthesis in isolated intact chloroplasts under constant light: Responses of carbon fluxes, metabolite pools and enzyme-activation states to changes of the electron pressure. Plant Cell Physiol. 38: 1207-1216.
- Fridlyand, L.E., Backhausen, J.E., Holtgrefe, S., Kitzmann, C. and Scheibe, R. (1997) Quantitative evaluation of the rate of 3-phosphoglycerate reduction in chloroplasts. Plant Cell Physiol. 38: 1177-1186.
- Baalmann, E., Scheibe, R., Cerff, R. and Martin, W. (1996) Functional studies of chloroplast glyceraldehyde-3-phosphate dehydrogenase subunits A and B expressed in Escherichia coli: Formation of highly active A4 and B4 homotetramers and evidence that aggregation of the B4 complex is mediated by the B subunit carboxy terminus. Plant Mol. Biol. 32: 505-513.
- Baalmann, E., Backhausen, J.E., Vetter, S. and Scheibe, R. (1995) Reductive modification and non-reductive activation of purified spinach chloroplast NADP-dependent glyceraldehyde 3-phosphate dehydrogenase. Arch. Biochem. Biophys. 324: 201-208.
- Faske, M., Holtgrefe, S., Ocheretina, O., Meister, M., Backhausen, J.E. and Scheibe, R. (1995) Redox equilibria between the regulatory thiols of light/dark-modulated enzymes and dithiothreitol: fine-tuning by metabolites. Biochim. Biophys. Acta 1247: 135-142.
- Baalmann, E., Backhausen, J.E., Kitzmann, C. and Scheibe, R. (1994) Regulation of NADP-dependent glyceraldehyde 3-phosphate dehydrogenase activity in spinach chloroplasts. Bot. Acta 107: 313-320.
- Backhausen, J.E., Kitzmann, C. and Scheibe, R. (1994) Competition between electron acceptors in photosynthesis: Regulation of the malate valve during CO2 fixation and nitrite reduction. Photosynth. Res. 42: 75-86.
- Scheibe, R. (1994) Lichtregulation von Chloroplastenenzymen. Naturwissenschaften 81: 443-448.
- Scheibe, R. (1991) Redox-modulation of chloroplast enzymes. A common principle for individual control. Plant Physiol. 96: 1-3.
- Scheibe, R. (1990) Light/dark modulation: Regulation of chloroplast metabolism in a new light. Bot. Acta 103: 327-334.
- Scheibe, R. and Stitt, M. (1988) Comparison of NADP-malate dehydrogenase activation, QA reduction and O2 evolution in spinach leaves. Plant Physiol. Biochem. 26: 473-481.
- Scheibe, R., Fickenscher, K. and Ashton, A.R. (1986) Studies on the mechanism of the reductive activation of NADP-malate dehydrogenase by thioredoxinm and low molecular weight thiols. Biochim. Biophys. Acta 870: 191-197.
- Scheibe, R. and Jacquot, J.-P. (1983) NADP regulates the light activation of NADP-dependent malate dehydrogenase. Planta 157: 548-553.
Malat-Ventile und Redox-Shuttle-Systeme in grünen und in nicht-grünen Geweben
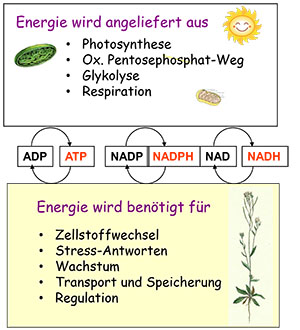
Die Bereitstellung von Reduktionsequivalenten NAD(P)H und von Energie in Form von ATP im benötigten Verhältnis ist Grundlage für den kontinuierlichen Ablauf der verschiedenen Syntheseprozesse. Pflanzenzellen besitzen Plastiden als speziell geeignetes Kompartiment für energiebedürftige Reaktionen. Durch kompartimentspezifische Isoenzyme der Malatdehydrogenase ist die Entkopplung beider Energieträger möglich, da Reduktionsequivalente in Form von Malat ins Cytosol transportiert werden können. Im Licht in grünen Geweben erfolgt die Regulation des Malat-Ventils über die redox-modulierte NADP-Malatdehydrogenase.
Im Dunkeln, aber auch in nicht-grünen Geweben, wird NADH mittels einer plastidären NAD-Malatdehydrogenase ins Cytosol transportiert, so dass bei der Substratkettenphosphorylierung gleichzeitig entstehendes ATP im Plastiden kontinuierlich genutzt werden kann. Auch in Knöllchen bei symbiontischer N2-Fixierung wird mittels einer plastidären NAD-Malatdehydrogenase die Verteilung von NADH und ATP bewerkstelligt. Das Fehlen der plastidären NAD-Malatdehydrogenase in transgenen Pflanzen ist embryoletal.
Die mitochondriale Malat-Oxidation ist am Abbau der Überreduktion in den Plastiden beteiligt. Die Bedeutung der verschiedenen Isoformen der Alternativen Oxidase (AOX) sowie Unterschiede in deren Regulation werden anhand von rekombinanten Proteinen analysiert.
Im Dunkeln, aber auch in nicht-grünen Geweben, wird NADH mittels einer plastidären NAD-Malatdehydrogenase ins Cytosol transportiert, so dass bei der Substratkettenphosphorylierung gleichzeitig entstehendes ATP im Plastiden kontinuierlich genutzt werden kann. Auch in Knöllchen bei symbiontischer N2-Fixierung wird mittels einer plastidären NAD-Malatdehydrogenase die Verteilung von NADH und ATP bewerkstelligt. Das Fehlen der plastidären NAD-Malatdehydrogenase in transgenen Pflanzen ist embryoletal.
Die mitochondriale Malat-Oxidation ist am Abbau der Überreduktion in den Plastiden beteiligt. Die Bedeutung der verschiedenen Isoformen der Alternativen Oxidase (AOX) sowie Unterschiede in deren Regulation werden anhand von rekombinanten Proteinen analysiert.
Literatur:
- Knuesting, J., Scheibe, R. und Selinski, J. (2020) Regulatory principles of energy fluxes and their impact on custom-designed plant productivity. In: Kumar, Ogita,Y-YS., Scheibe, R. editors: Climate Change, Photosynthesis and Advanced Biofuels: Role of Biotechnology in Production of Value-added Plant Products. Springer, in press
- Scheibe, R. (2019) Maintaining homeostasis by controlled alternatives for energy distribution in plant cells under changing conditions of supply and demand. Photosynthesis Research 139:81-91, doi.org/10.1007/s11120-018-0583-z
- Selinski, J., Scheibe, R., Day, D. A. and Whelan, J. (2018) Alternative oxidase is positive for plant performance. Trends in Plant Science 23:588-597, doi.org/10.1016/j.tplants.2018.03.012
- Scheibe, R. (2018) Maintaining homeostasis by controlled alternatives for energy distribution in plant cells under changing conditions of supply and demand. Photosynthesis Research
- Knuesting, J. and Scheibe, R. (2018) Small molecules govern thiol-redox switches Trends in Plant Science 23(9): 769-782.
- Selinski, J. and Scheibe, R. (2018) Malate valves: old shuttles with new perspectives Plant Biology ISSN 1435-8603
- Selinski, J., Scheibe, R., Day, D. A. and Whelan, J. (2018) Alternative oxidase is positive for plant performance Trends in Plant Science 23:588-597
- Selinski, J., Hartmann, A., Deckers-Hebestreit, G., Day, D. D., Whelan, J. and Scheibe, R. (2018) Alternative oxidase isoforms are differentially activated by tricarboxylic acid cycle intermediates. Plant Physiol 176:1423-1432
- Selinski, J., Hartmann, A., Kordes, A., Deckers-Hebestreit, G., Whelan, J., and Scheibe, R. (2017) Analysis of post-translational activation of alternative oxidase isoforms. Plant Physiol 174: 2113-2127
- Selinski, J., Hartmann, A., Höfler, S., Deckers-Hebestreit, G., and Scheibe, R. (2016) Refined method to study the post-translational regulation of alternative oxidases from Arabidopsis thaliana in vitro. Physiol. Plant. 157:264-279
- Vishwakarma, A., Tetali, S. D., Selinski, J., Scheibe, R., and Padmasree, K. (2015) Importance of alternative oxidase pathway in regulating cellular redox and ROS homeostasis to optimize photosynthesis during restriction of cytochrome oxidase pathway in Arabidopsis thaliana, Annals of Botany, 1-15.
- Selinski, J. & Scheibe, R. (2014) Pollen tube growth: Where does the energy come from? Plant Signal Behav. 9(12)
- Vishwakarma, A., Bashyam, L., Senthilkumaran, B., Scheibe, R., and Padmasree, K. (2014) Physiological role of AOX1a in photosynthesis and maintenance of cellular redox homeostasis under high light in Arabidopsis thaliana. Plant Physiol. Biochem. 81: 44-53.
- elinski, J., and Scheibe, R. (2014) Lack of malate valve capacities lead to improved N-assimilation and growth in transgenic A. thaliana plants. Plant Signaling & Behavior 9: e29057-1 - e29057-5.
- Selinski, J., König, N., Wellmeyer, B., Hanke, G.T., Linke, V., Neuhaus, H.E., and Scheibe, R. (2014) The plastid-localized NAD-dependent malate dehydrogenase is crucial for energy homeostasis in developing Arabidopsis thaliana seeds. Mol. Plant 7: 170-186.
- Hebbelmann, I.*, Selinski, J.*, Wehmeyer, C., Goss, T., Voss, I., Mulo, P., Kangasjärvi, S., Aro, E.-M., Oelze, M.-L., Dietz, K.-J., Nunes-Nesi, A., Thi-Do, P., Fernie, A., Talla, S.K., Raghavendra, A.S., Linke, V., and Scheibe, R. (2012) Multiple strategies to prevent oxidative stress in Arabidopsis plants lacking the malate-valve enzyme NADP-malate dehydrogenase. J. Exp. Bot. 63: 1445-1459.
- Scheibe, R., and Dietz, K.-J. (2012) Reduction-oxidation network for flexible adjustment of cellular metabolism in photoautotrophic cells. Plant Cell Environ. 35: 202-216.
- Strodtkötter, I., Padmasree, K., Dinakar, C., Speth, B., Niazi, P.S., Wojtera, J., Voss, I., Do, P.T., Nunes-Nesi, A., Fernie, A.R., Linke, V., Raghavendra, A.S. and Scheibe, R. (2009) Induction of the AOX1D isoform of alternative oxidase in A. thaliana T-DNA-insertion lines lacking isoform AOX1A is insufficient to optimize photosynthesis when treated with antimycin A. Mol. Plant 2: 284-297.
- Voss, I., Koelmann, M., Wojtera, J., Holtgrefe, S., Kitzmann, C., Backhausen, J.E. and Scheibe, R. (2008) Knock-out of major leaf ferredoxin reveals new redox-regulatory adaptations in Arabidopsis thaliana. Physiol. Plant. 133: 584-598.
- Scheibe, R., Backhausen, J.E., Emmerlich, V. and Holtgrefe, S. (2005) Strategies to maintain redox homeostasis during photosynthesis under changing conditions. J. Exp. Bot. 56: 1481-1489.
- Scheibe, R. (2004) Malate valves to balance cellular energy supply. Physiol. Plant. 120: 21-26.
- Berkemeyer, M., Scheibe, R. and Ocheretina, O. (1998) A novel, non-redox-regulated NAD-dependent malate dehydrogenase from chloroplasts of Arabidopsis thaliana L. J. Biol. Chem. 273: 27927-27933.
- Backhausen, J.E., Emmerlich, A., Holtgrefe, S., Horton, P., Nast, G., Rogers, J.J.M., Müller-Röber, B. and Scheibe, R. (1998) Transgenic potato plants with altered expression levels of chloroplast NADP-malate dehydrogenase: Interactions between photosynthetic electron transport and malate metabolism in leaves and in isolated intact chloroplasts. Planta 207: 105-114.
- Backhausen, J.E., Vetter, S., Baalmann, E., Kitzmann, C. and Scheibe, R. (1998) NAD-dependent malate dehydrogenase and glyceraldehyde 3-phosphate dehydrogenase isoenzymes play an important role in dark metabolism of various plastid types. Planta 205: 359-366.
Redox-gesteuerte Genexpression zur Regulation des Energiestoffwechsels
Die flexible Anpassung der Elektronenflüsse auf die hierarchisch angeordneten Akzeptorsysteme (CO2, Nitrit, Sulfat, O2 etc.) wird durch angepasste Aktivierungszustände, erhöhte Intermediat-Pools sowie durch veränderte Enzymausstattung erreicht.
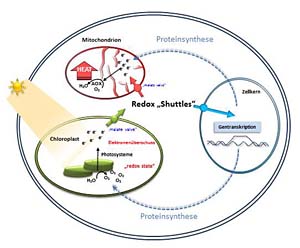
Die stark kontrollierte Aktivität der NADP-MDH kann als Teil des Malat-Ventils nicht nur wesentlich zur Anpassung des stromalen ATP/NADPH-Verhältnisses beitragen, sondern stellt auch eine wichtige Verbindung zwischen C- und N-Stoffwechsel dar. Erhöhte CO2-Konzentration, Nährstoffversorgung und wechselnde Lichtbedingungen werden als variable Umweltfaktoren einbezogen. In Situationen, in denen sich Chloroplasten über längere Zeit z. B. durch Akzeptormangel unter hohem Elektronendruck befinden, wird die Genexpression für kernkodierte chloroplastidäre Proteine beeinflusst, um langfristig eine Anpassung an die veränderten Bedingungen zu erzielen. Teilschritte der Übermittlung eines Redox-Signals aus den Plastiden über das Cytosol in den Kern werden gezielt analysiert. Die Rolle cytosolischer Enzyme und ihrer Modifikation durch S-Glutathionylierung und S-Nitrosylierung sowie die Beteiligung weiterer redox-aktiver Proteine ist dabei von besonderem Interesse. Ebenso wird die Kerntranslokation cytosolischer Enzyme und deren Funktion in der Genexpression untersucht.
Literatur:
- Schorsch, M., Kramer, M., Goss, T., Eisenhut, M., Robinson, N., Osman, D., Wilde, A., Sadaf, S., Brückler, H., Walder, L., Scheibe, R., Hase, T. und Hanke, G. T. (2018) A unique ferredoxin acts as a novel player in the low iron response of photosynthetic organisms. PNAS 115(51) E12111-E12120, http://www.pnas.org/cgi/doi/10.1073/pnas.1810379115
- Schneider, M., Knüsting, J., Birkholz, O., Heinisch, J. J., and Scheibe, R. (2018) Cytosolic GAPDH as a redox-dependent regulator of energy metabolism. BMC Plant Biology 18(184), doi.org/10.1186/s12870-018-1390-6
- Aroca, A., Schneider, M., Scheibe, R., Gotor, C., and Romero, L. C. (2017) Hydrogen sulfide regulates the cytosolic/nuclear partitioning of glyceraldehyde-3-phosphate dehydrogenase by enhancing its nuclear localization. Plant and Cell Physiology 58: 983-992.
- Hildebrandt, T., Knuesting, J., Berndt, C., Morgan, B., and Scheibe, R. (2015) Cytosolic thiol switches regulating basic cellular functions: GAPDH as an information hub? Biological Chemistry, 396: 523-537.
- Zachgo, S., Hanke, G.T., and Scheibe, R. (2013) Plant cell microcompartments: a redox-signaling perspective. Biol. Chem. 394: 203-216.
- Voss, I., Sunil, B., Scheibe, R., and Raghavendra, A.S. (2013) Emerging concept for the role of photorespiration as an important part of abiotic stress response. Plant Biology 56: 435-447.
- van der Linde, K., Gutsche, N., Leffers, H.-M., Lindermayr, C., Müller, B., Holtgrefe, S., and Scheibe, R. (2011) Regulation of plant cytosolic aldolase functions by redox-modifications. Plant Physiol. Biochem. 49: 946-957.
- Holtgrefe, S., Gohlke, J., Starmann, J., Druce, S., Klocke, S., Altmann, B., Wojtera, J., Linke, V., Lindermayr, C. and Scheibe, R. (2008) Regulation of plant cytosolic glyceraldehyde 3-phosphate dehydrogenase isoforms by thiol modification. Physiol. Plant. 133: 211-228.
- Hameister, S., Becker, B., Holtgrefe, S., Linke, V., Backhausen, J.E. and Scheibe, R. (2007) Transcriptional regulation of the NADP-dependent malate dehydrogenase: Comparative genetics and identification of DNA-binding proteins. J. Mol. Evol. 65: 437-455.
- Wormuth, D., Baier, M., Kandlbinder, A., Scheibe, R., Hartung, W. and Dietz, K.-J. (2006) Regulation of gene expression by photosynthetic signals triggered through modified CO2 availability. BMC Plant Biology 6: 15 ff.
- Becker, B., Holtgrefe, S., Jung, S., Wunrau, C., Kandlbinder, A., Baier, M., Dietz, K.-J., Backhausen, J.E. and Scheibe, R. (2006) Influence of the photoperiod on redox regulation and stress responses in Arabidopsis thaliana L. (Heynh.) plants under long- and short-day conditions. Planta 224: 380-393.
- Scheibe, R., Backhausen, J.E., Emmerlich, V. and Holtgrefe, S. (2005) Strategies to maintain redox homeostasis during photosynthesis under changing conditions. J. Exp. Bot. 56: 1481-1489.
- Holtgrefe, S., Bader, K.P., Horton, P., Scheibe, R., von Schaewen, A. and Backhausen, J.E. (2003) Decreased content of leaf ferredoxin changes electron distribution and limits photosynthesis in transgenic potato plants. Plant Physiol. 133: 1768-1778.
Protein-Protein-Wechselwirkungen an Cytoskelett und äußerer Mitochondrienmembran
Sowohl die Assoziationen zwischen den verschiedenen Proteinen als auch ihre Verbindung mit dem Cytoskelett und mit der äußeren Membran von Mitochondrien wird analysiert. Eine eventuelle Rolle derartiger Mikrokompartimente in der Übermittlung eines Redox-Signals an den Kern wird ebenfalls in Betracht gezogen. Insbesondere die Rolle von VDAC (voltage-dependent anion channel), die redox-abhängige Assoziation mit GapC (cytosolische GAPDH) und die Lokalisierung der Mitochondrien bei Imbalancen in der Redox-Homöostase werden analysiert, indem in vivo und in vitro diverse Fusionsproteine mit Fluoreszenzmarkierung eingesetzt werden. Die Cysteinreste im aktiven Zentrum des Glykolyse-Enzyms GAPDH sind besonders sensitiv gegenüber oxidierenden Bedingungen. Modifikation und Inaktivierung der GAPDH und das damit verbundene "moonlighting" dient offensichtlich als Schnittstelle zwischen Metabolismus und veränderter Genexpression.
Literatur:
- Hildebrandt, T., Knuesting, J., Berndt, C., Morgan, B., and Scheibe, R. (2015) Cytosolic thiol switches regulating basic cellular functions: GAPDH as an information hub? Biological Chemistry, 396: 523-537.
- Zachgo, S., Hanke, G.T., and Scheibe, R. (2013) Plant cell microcompartments: a redox-signaling perspective. Biol. Chem. 394: 203-216.
- Wojtera-Kwiczor, J., Groß, F., Leffers, H.-M., Kang, M., Schneider, M., and Scheibe, R. (2013) Transfer of a redox-signal through the cytosol by redox-dependent microcompartmentation of glycolytic enzymes at mitochondria and actin cytoskeleton. Frontiers in Plant Science 3: Article 284.
- van der Linde, K., Gutsche, N., Leffers, H.-M., Lindermayr, C., Müller, B., Holtgrefe, S., and Scheibe, R. (2011) Regulation of plant cytosolic aldolase functions by redox-modifications. Plant Physiol. Biochem. 49: 946-957.
- Holtgrefe, S., Gohlke, J., Starmann, J., Druce, S., Klocke, S., Altmann, B., Wojtera, J., Linke, V., Lindermayr, C. and Scheibe, R. (2008) Regulation of plant cytosolic glyceraldehyde 3-phosphate dehydrogenase isoforms by thiol modification. Physiol. Plant. 133: 211-228.
- Holtgraewe, D., Scholz, A., Altmann, B. and Scheibe, R. (2005) Cytoskeleton-associated, carbohydrate-metabolizing enzymes in maize identified by yeast two-hybrid screening. Physiol. Plant. 125: 141-156.
GrxS17 als Schalter zur Integration von Informationen
Das ungewöhnliche Glutaredoxin GrxS17 spielt eine übergeordnete Rolle für die Differenzierung der Meristeme nach der Blühinduktion. Die molekularen, zellbiologischen und physiologischen Aspekte dieses für höhere Pflanzen typischen Proteins werden im Rahmen eines Teilprojekts in der DFG-geförderten Forschergruppe SPP 1710 >>Dynamics of Thiol-based Switches in Cellular Physiology<< untersucht.
Literatur:
- Martins, L., Knuesting, J., Bariat, L., Dard, A., Freibert, S.A., Marchand, C.H., Young, D., Nguyen, H.T.D., Debures, A., Saez-Vasquez, J., Lemaire, S.D., Lill, R., Messens, J., Scheibe, R., Reichheld, J.-P. und Riondet, C. (2020) Redox response of iron-sulfur glutaredoxin GRXS17 activates its holdase activity to protect plants from heat stress. bioRxiv preprint first posted online Jan. 7, 2020, dx.doi.org/10.1101/2020.01.07.896506
- Knuesting, J., Riondet, C., Maria, C., Kruse, I., Bécuwe, N., König, N., Berndt, C., Tourrette, S., Guilleminot-Montoya, J., Herrero, E., Gaymard, F., Balk, J., Belli, G., Scheibe, R., Reichheld, J. P., Rouhier, N., and Rey, P. (2015) Arabidopsis glutaredoxin S17 and its partner NF-YC11/NC2α contribute to maintenance of the shoot apical meristem under long-day photoperiod. Plant Physiology 167: 1643-1658.
Ökophysiologie
In verschiedenen Projekten werden im Freiland und im Gewächshaus unter kontrollierten Bedingungen abiotische Einflüsse, insbesondere durch Licht und Temperatur, auf das Pflanzenwachstum, sowie Verteilung und Konkurrenz der Pflanzen untersucht.
Literatur:
- Neuffer, B., Schorsch, M., Hameister, S., Knüsting, J., Selinski, J. und Scheibe, R. (2020) Physiological and anatomical differentiation of two sympatric weed populations. PeerJ, in press
- Knuesting, J., Brinkmann, MC., Brenner, S., Schorsch, M., Bendix, J., Beck, E. and Scheibe, R. (2018) Who will win where and why? An ecophysiological dissection of the competition between a tropical pasture grass and the invasive weed Bracken over an elevation range of 1000 m in the tropical Andes PLOS One 13(8): e0202255
- Knuesting, J., Schorsch, M., Voss, I., Brenner, S., Bendix, J., Strobl, S., Beck, E., and Scheibe, R. (2015) Modeling the competition between the pasture grass Setaria sphacelata and bracken: Comparision of photosynthetic capacities at different altitudes. Tabebuia Bulletin 1: 16-19.
- Strobl, S., Cueva, E., Brenner, S., Knuesting, J., Schorsch, M., Scheibe, R., Bendix, J. and Beck, E. (2017) Water relations and photosynthetic water use efficiency as indicators of slow climate change effect on trees in a tropical mountain forest in South Ecuador. Ecological Indicators 83: 550-558
- Neuffer, B., Wesse, C., Voss, I. and Scheibe, R. (2018) The role of ecotypic variation in driving worldwide colonisation by a cosmopolitan plant. AOB Plants, in press.
- Wojtera-Kwiczor, J., Zukowska, W., Graj, W., Malecka, A., Piechalak, A., Ciszewska, L., Chrzanowski, L., Lisiecki, P., Komorowicz, I., Baralkiewicz, D., Voss, I., Scheibe, R. and Tomaszewska1, B. (2014) Rhizomediation of Diesel-contaminated soil with two rapeseed varieties and petroleum degraders reveals different responses of the plant defense mechanisms. International Journal of Phytoremediation 16: 770-789.
- Silva, B., Roos, K., Voss, I., König, N., Rollenbeck, R., Scheibe, R., Beck, E., and Bendix, J. (2012) Simulating canopy photosynthesis for two competing species of an anthropogenic grassland community in the Andes of southern Ecuador. Ecological Modeling 239: 14-26
- Silva, B., Dislich, C., Voss, I., Roos, K., Scheibe, R., Vorpahl, P., Schroeder, B., Huth, A., Beck, E., and Bendix, J. (2013) Climate change and its impact on current and future vegetation dynamics and carbon cycling. Ecological Studies 221, Chapter 24.